- Solide
- Liquide
- Gazeux
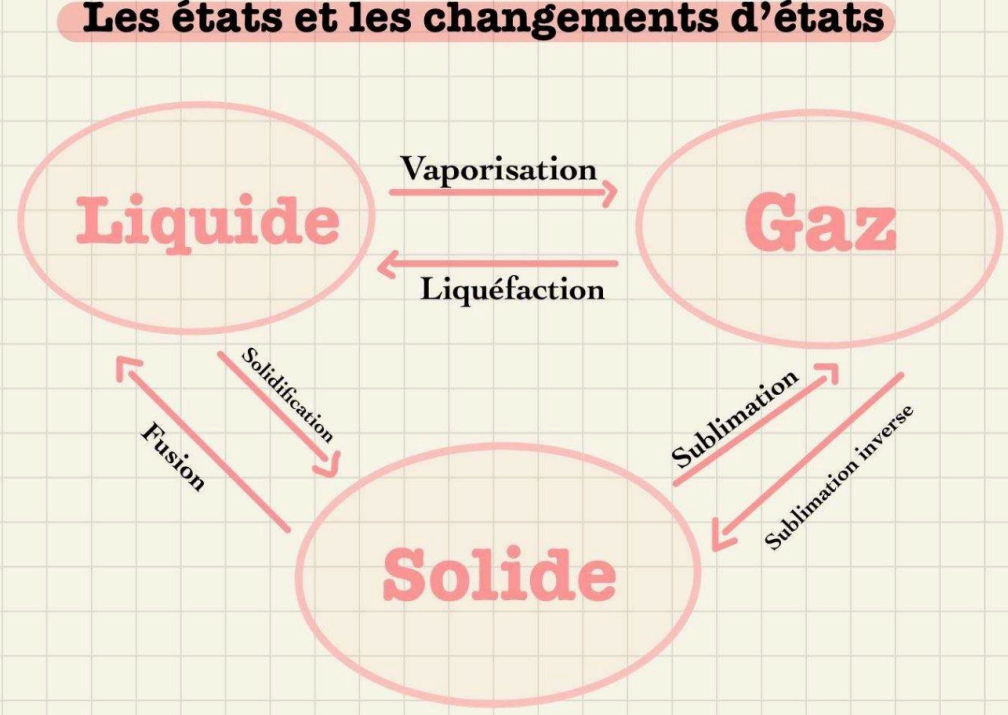



- Les points d'ébulition sont représentés par des plateaux/paliers sur le graphique de la température.
ATTENTION!: La température ambiante est aussi un plateau mais n'est pas un point d'ébulition. - C'est la température à laquelle une substance se met à changer d'état.
p.ex. l'eau à 0°C est à la fois solide et liquide et à 100°C elle est à la fois liquide et gazeuse - Les corps purs
- Simples: C'est une substance composée d'atomes identiques
- Composés: C'est une substance composée d'atomes différents
- Les mélanges
- Hétérogène: On distingue au moins deux constituants à l'oeil nu ou à l'aide d'un microscrope si on ne voit pas à travers. Exemple: Eau/huile
- Homogène: On ne peut pas distinguer les constituants d'un mélange même avec un microscope puissant ou si on voit à travers. Exemple: Eau/Alcool
- Si on dissout du sel dans de l'eau, le sel est le le soluté et l'eau le solvant.
- Un mélange gazeux est toujours homogène !
- Alliage homogène: métaux qui sont miscibles entre eux, en les chauffant (bronze, fonte, acier, laiton, ...)
- Méthodes de séparation
- Décantation
- Filtration
- Centrifugation
- Évaporation et vaporisation
- Distillation
- Chromatographie
- Ordres de grandeur
- Puce
- Paramécie
- Cellule
- Bactérie
- Virus
- Macromolécules
- Molécules
- Atomes
- L'atome est composé de :
- protons, chargés positivement
- neutrons, neutres
- électrons, chargés négativement
- Le nombre de protons = Le nombre de neutrons, car l'atome est électriquement neutre.
Matériel : Ampoule à décanter
Principe: la substance descend.
Pour: L-L ou S-L
Exemple: Argile et eau salée.
Matériel : Papier filtre
Principe: La différence de solubilité
Pour: S-L
Exemple: Argile et eau salée
Matériel: Centrifugeuse, Récipients
Principe: tourner à grande vitesse
Pour: S-L
Exemple: Argile et eau
Matériel: Bec Bunsen
Principe: On chauffe
Pour: S-L
Exemple : Eau et sel
Matériel: Ballon, colonne de distillation
Principe: La différence des points d'ébullition
Pour: L-L ou S-L
Exemple: Vin
Pour: les couleurs , S-L
Décroissant, du plus grand au plus petit